Des nanoparticules magnétiques pour optimiser la pénétration des cellules thérapeutiques dans les tumeurs
Véritable révolution pour les thérapies immunitaires, les cellules CAR T restent cependant peu efficaces contre les tumeurs solides. Des chercheurs et chercheuses ont développé un procédé, à base de nanoparticules magnétiques, pour faciliter la pénétration des cellules CAR T dans les tumeurs solides et pouvoir les suivre par IRM. Publiés dans la revue Advanced Functional Materials, ces résultats reposent sur des méthodes adaptables aux procédés cliniques.
Les thérapies immunitaires par les cellules CAR T, pour Chimeric antigen receptor T, consistent à isoler les lymphocytes T d’un patient, à les reprogrammer afin qu’ils reconnaissent et tuent ses cellules cancéreuses, puis à les lui réinjecter. Cette nouvelle approche rencontre un franc succès dans le traitement des cancers hématologiques, mais reste peu efficace contre les tumeurs solides, que les cellules CAR T peinent à pénétrer. De plus, aucune technique d’imagerie ne permet de vérifier l’infiltration effective de ces cellules dans les tumeurs. Des chercheurs et chercheuses du laboratoire Matière et systèmes complexes (MSC, CNRS/Univ. Paris Cité), de l’Institut Cochin (CNRS/Inserm/Univ. Paris Cité), de l’Institut de pharmacologie et biologie structurale (IPBS, CNRS/Univ. Toulouse Paul Sabatier), du Laboratoire de chimie et biochimie pharmacologiques et toxicologiques (LCBPT, CNRS/Université Paris Cité) et du Paris centre de recherche cardiovasculaire (PARCC, Inserm/Univ. Paris Cité) sont parvenus, grâce à des nanoparticules magnétiques, à suivre les cellules CAR T par IRM et à les aider à mieux pénétrer dans des tumeurs solides, augmentant ainsi leur efficacité antitumorale.
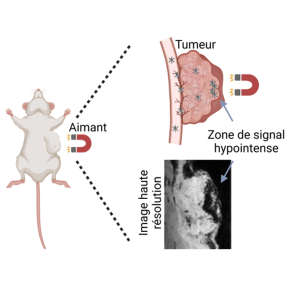
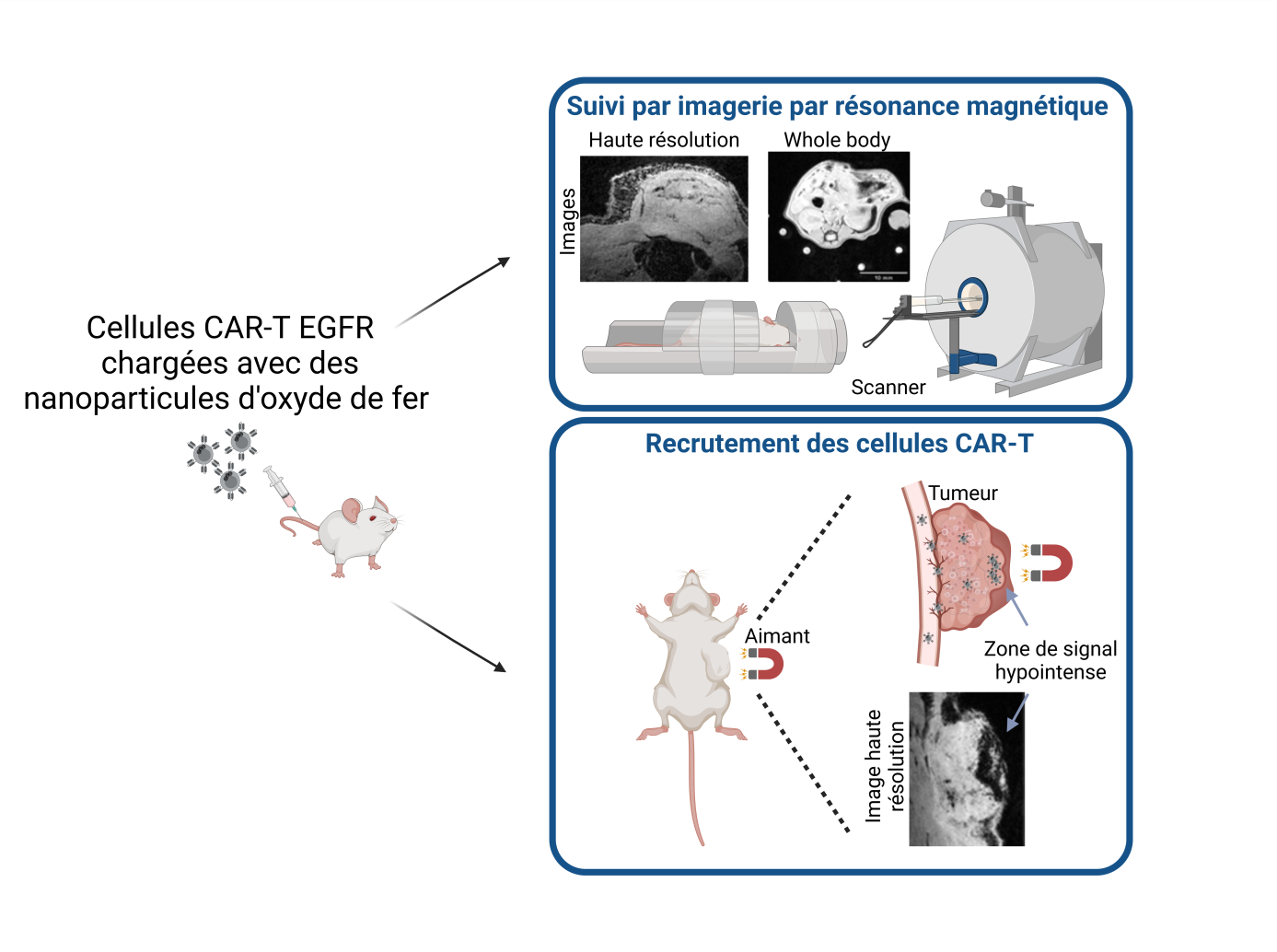
Les nanoparticules d’oxyde de fer ont été synthétisées grâce à un procédé vert, peu coûteux et industrialisable. Les cellules CAR T les internalisent par simple incubation en moins de deux heures, sans affecter leur capacité à migrer, à reconnaître les tumeurs et à s’activer pour tuer les cellules malignes. Devenues magnétiques, les cellules CAR T sont visibles par IRM, sous forme d’un signal noir, et peuvent être attirées par un aimant. Les scientifiques sont ainsi parvenus à visualiser, chez des souris porteuses d’une tumeur sous-cutanée, la cinétique de leur distribution dans l’organisme et de leur infiltration dans la tumeur, et ce jusqu’à plusieurs semaines après administration. Grâce à cela, l’équipe a constaté que les cellules CAR T migrent plus rapidement et en plus grand nombre dans la tumeur que les cellules non modifiées, ce qui fait régresser davantage la tumeur en question. Les cellules CAR T peuvent aussi migrer plus tôt et en plus grand nombre dans la tumeur si elles sont guidées par un aimant, ici maintenu au niveau de la tumeur par un gilet pour souris. Les méthodes de marquage cellulaire des cellules CAR T, tout comme leur suivi par IRM et leur guidage magnétique, sont suffisamment simples pour être intégrables à des thérapies cliniques.
Cette approche pourrait aider à identifier précocement les patients sensibles ou résistants aux immunothérapies cellulaires et à augmenter les chances de succès de ces thérapies. Les chercheurs et chercheuses tentent à présent de vérifier si leurs résultats seraient transférables à l’homme, pour traiter des tumeurs localisées.
© Chen et al.
Références
In Vivo Monitoring and Magnetically-Enhanced Delivery of CAR T-Cells to Solid Tumor.
Huan Chen, Alice Machado, Dongjie An, Sonia Becharef, Gwennhael Autret, Dmitry Ayollo, Sarah Razafindrakoto, Philippe Nizard, Florent Carn, Yun Luo, Frédéric Pendino, Claire Mangeney, Jelena Kolosnjaj-Tabi, Emmanuel Donnadieu, Florence Gazeau.
Advanced Functional Materials, 2024.
https://doi.org/10.1002/adfm.202414368